Petites molécules organiques modulatrices de l'activité Rad51
Les thérapies anticancéreuses se heurtent fréquemment aux radio- et chimio-résistances induites ou intrinsèques des cellules cancéreuses. De fait, il a été démontré que certaines voies de réparation de l'ADN, étaient capables de restaurer l'ADN de cellules cancéreuses, endommagé au cours de traitements par les radio- ou chimiothérapies. Ces mécanismes sont depuis apparus comme des cibles thérapeutiques d’intérêt pour sensibiliser les tumeurs.
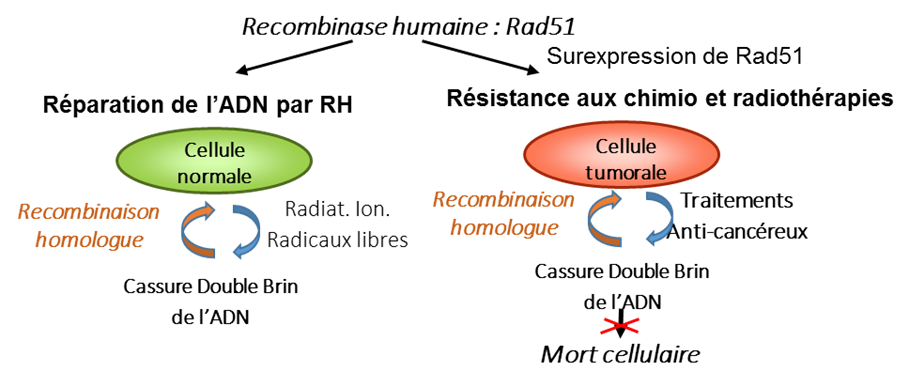
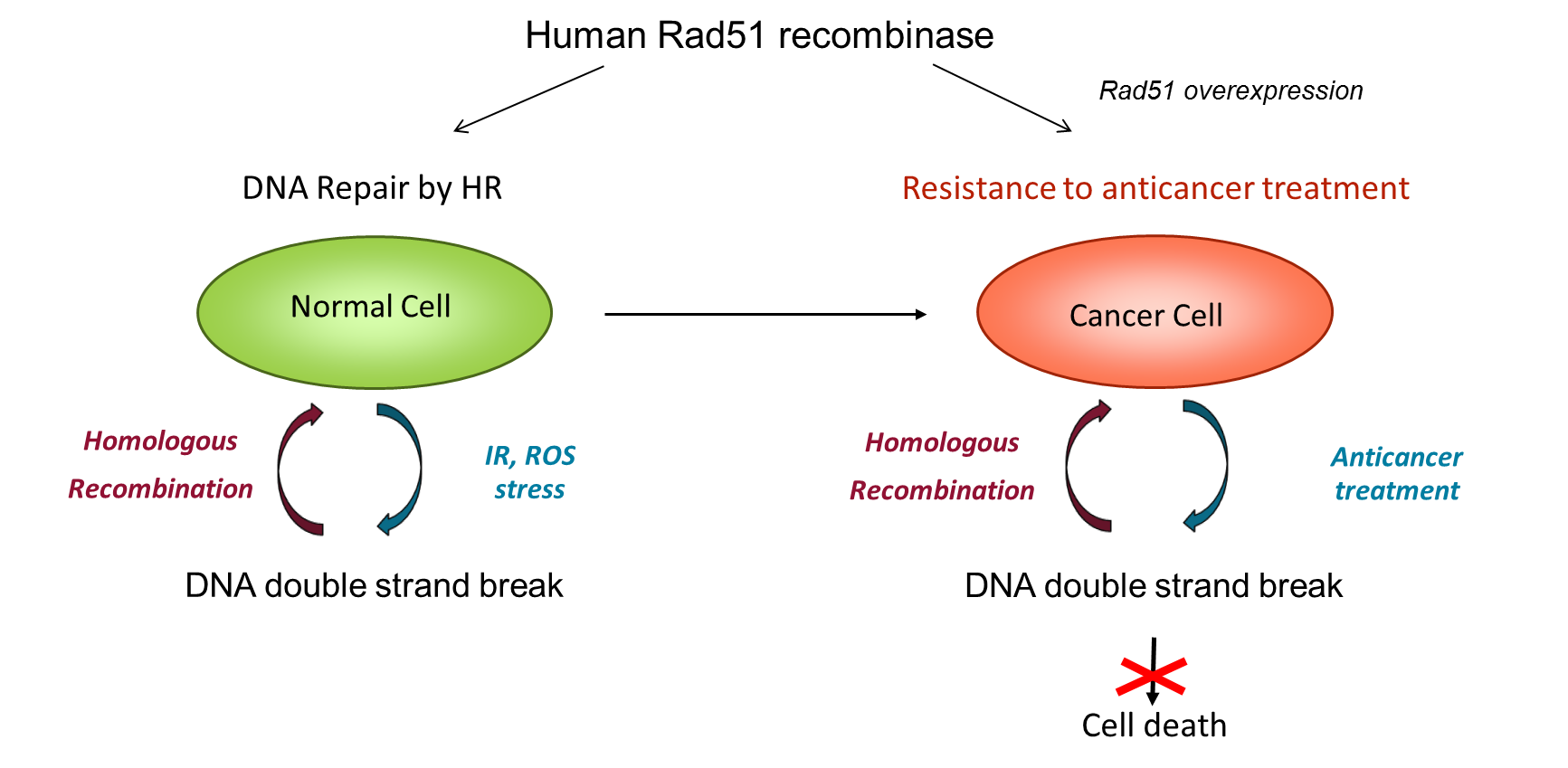
Les cassures doubles brin (CDB) de l’ADN sont les altérations nucléiques les plus délétères qui peuvent être réparées par la voie de la recombinaison homologue (RH). La protéine Rad51 est l'élément principal de cette voie de réparation. L’activité recombinase est constituée de plusieurs étapes. La première étape nécessite la formation d'un nucléofilament de Rad51 qui catalyse la recherche d'homologie et l'échange de brin entre la séquence d'ADN endommagée et une séquence homologue assurant ainsi la réparation fidèle de la CDB.
Une dérégulation de Rad51 peut aboutir à la cancérogenèse et favoriser la résistance de ces cancers. La surexpression de Rad51 conduit en effet à un taux élevé de RH et provoque une instabilité génomique des cellules à l'origine de certains cancers (Raderschall et al., Cancer Res. 2002, 62, 219). De plus, dans des cellules cancéreuses, cette surexpression assure une résistance en favorisant la réparation des CDB induites par les traitements anticancéreux. Il a été montré que la survie de patients atteints d’un cancer exprimant un taux plus élevé de Rad51 est plus courte et qu’une diminution de la quantité de Rad51 par un traitement antisens ou ribozyme augmente l’efficacité du traitement du cancer par radiothérapie (Ohnishi et al., BBRC, 1998, 245, 319 ; Collis et al., NAR, 2001, 29, 1534).
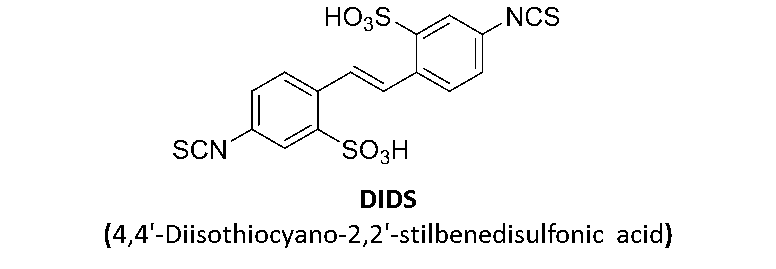
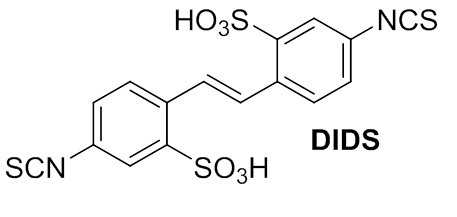
Rad51 constitue donc aujourd’hui une cible pertinente pour moduler la RH et ainsi potentialiser les traitements antitumoraux. L’identification de petites molécules présentant des activités anti-recombinase a suscité un intérêt croissant ces dernières années avec l’identification de plusieurs molécules inhibitrices de Rad51 (Berte et al., Mol Cancer Ther. 2016, 15, 2665). Ces inhibiteurs peuvent interférer les interactions protéine-protéine qui sont directement impliquées dans certaines étapes de l’activité de Rad51 et ainsi conduisent à limiter la voie de réparation RH. Parmi ces inhibiteurs potentiels, une équipe japonaise a montré qu’une petite molécule, le DIDS (4,4'-Diisothiocyano-2,2'-stilbene disulfonic acid) issue du criblage de chimiothèques, était capable d’inhiber l’activité recombinase de Rad51 au cours de la RH (Ishida et al., NAR. 2009, 37,3367).
A partir de cette molécule, notre projet consiste à développer de nouveaux inhibiteurs de Rad51 plus spécifiques des interfaces protéiques. L'approche multidisciplinaire associant la biologie, chimie et modélisation moléculaire, rend possible l'élaboration et l'évaluation de petites molécules plus efficace dans un contexte in vitro et in vivo.
Les informations ainsi obtenues pourraient permettre d'ouvrir de nouvelles perspectives en terme de développement d'agents sensibilisateurs aux thérapies anticancéreuses mais également en terme de compréhension du mécanisme de réparation de l'ADN par RH.
Small molecule inhibitors of Rad 51 activity
Anti-cancer therapies frequently encounter induced and intrinsic radio- and chemoresistance. This can be due to some DNA repair pathways which restore the DNA of cancer cells, damaged during radio- or chemotherapies. These mechanisms have since emerged as therapeutic targets of interest to sensitize tumors.
Double-strand breaks (DSBs) of DNA are the most deleterious alterations that can be repaired by the homologous recombination (RH) pathway. The Rad51 protein is the main element of this repair way. Deregulation of Rad51 can lead to carcinogenesis and then promote the resistance to treatments. The overexpression of Rad51 indeed leads to a high level of RH associated with genomic instability of the cells that could be at the origin of some cancers (Cancer Res, 2002, 62, 219). This overexpression provides resistance by promoting the repair of treatment-induced DSBs. It has been shown that the survival of cancer patients expressing a higher level of Rad51 is shorter and that a decrease in the amount of Rad51 by antisense or ribozyme treatment increases the efficiency of cancer treatment by radiotherapy. (BBRC, 1998, 245, 319, NAR, 2001, 29, 1534).
Rad51 is therefore today a relevant target to modulate HR and thus potentiate antitumor treatments.
Molecules exhibiting anti-recombinase activities are increasingly attractive and several Rad51 small molecules have been identified over the last decade (Mol Cancer Ther., 2016, 15, 2665). These inhibitors may interfere with protein-protein interactions that are directly involved in some steps of Rad51 activity and thus lead to limit the RH repair pathway. Among these potential inhibitors, a Japanese team has shown that a small molecule, DIDS (4,4'-Diisothiocyano-2,2'-stilbene disulfonic acid) identified from libraries screening, was able to block Rad51 recombinase activity during HR (NAR 2009, 37,3367).
From this lead molecule, DIDS, our project consists to develop new analogues, as potential inhibitors of Rad51 with protein-protein interface recognition. The multidisciplinary approach combining biologists (UFIP, UMR 6286, Nantes), organic chemists and molecular modeling chemists (CEISAM UMR 6230, Symbiose and MoDES teams, Nantes) open the way to rationally synthesize and then evaluate small molecules in an in vitro and in vivo context. The results thus obtained can offer therapeutic interest developing novel sensitizing agents for anticancer therapies but also fundamental interest in better understanding of the mechanism of DNA repair by HR.
English version RhoA PPI, Flyer and Poster, download here:
Téléchargez ici le flyer et le poster de la PPI RhoA en version française :